Recycling ist auch im menschlichen Körper wichtig: Ein gestörtes Recycling von Proteinen schädigt die Herzgesundheit
Ein Enzym namens Ubiquitin-spezifische Peptidase 5 ist ein bestimmender Faktor für die Proteinqualität in Herzmuskelzellen
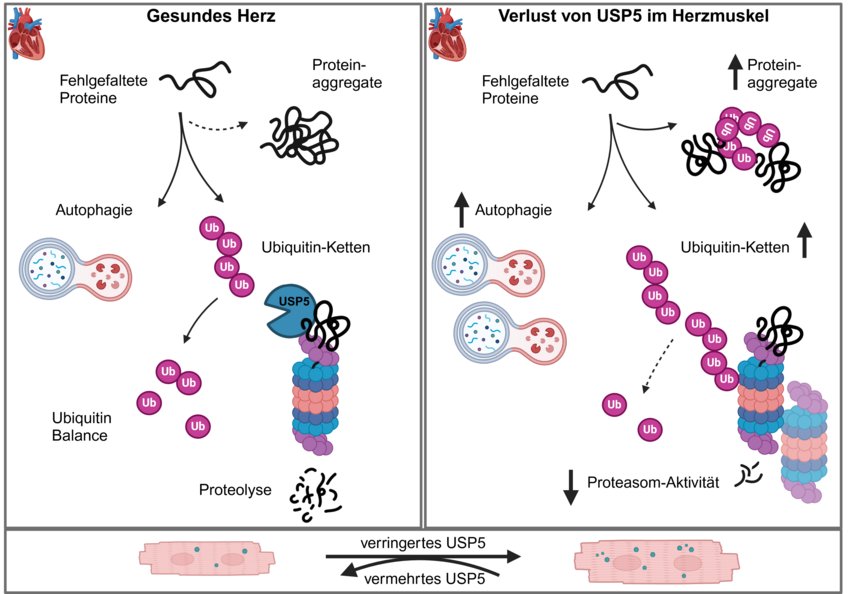
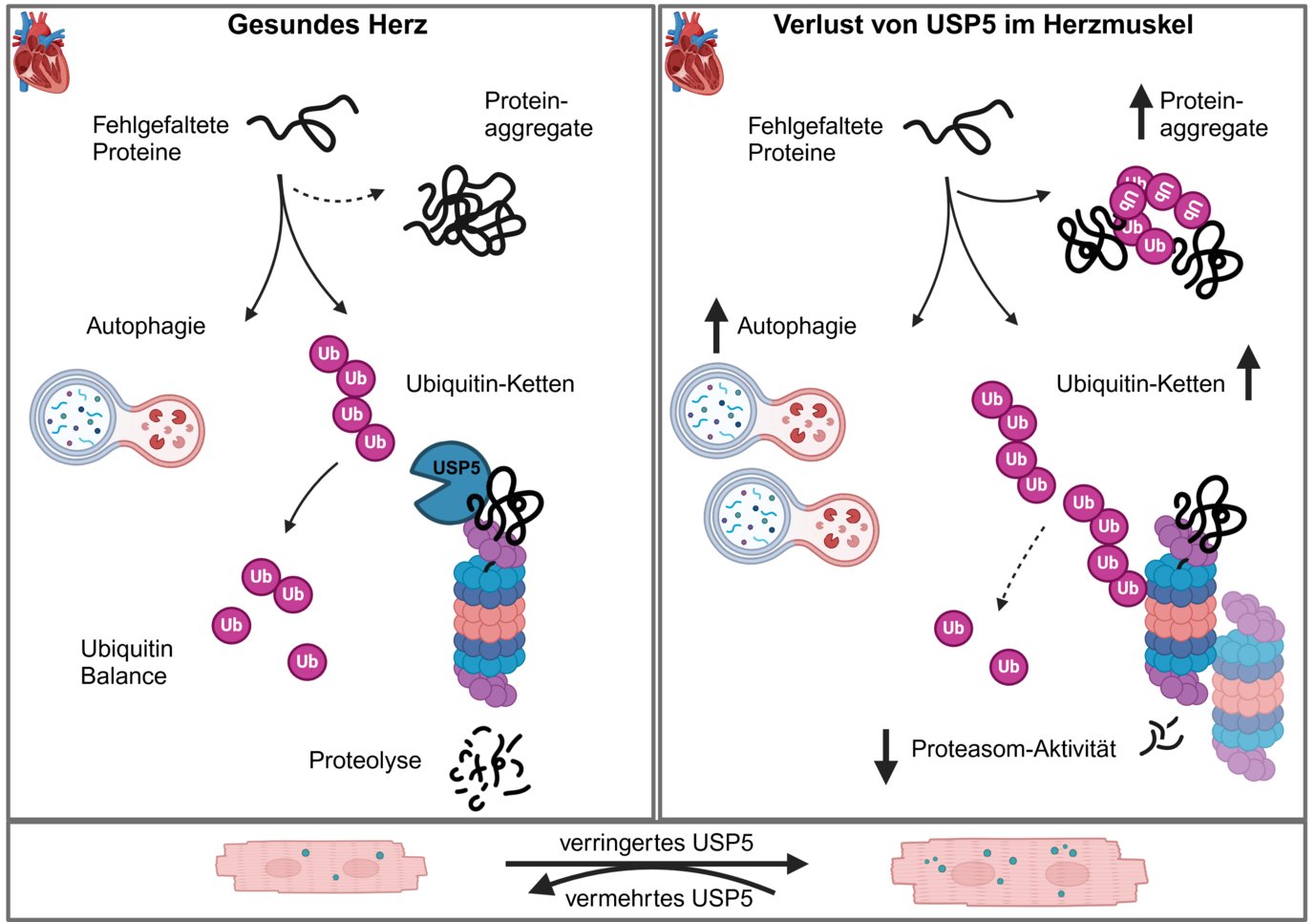
Der gestörte Abbau von Proteinen in Herzmuskelzellen kann zu einer Reihe von schwerwiegenden Herzerkrankungen führen. Im Falle der dilatativen Kardiomyopathie, einer krankhaften Erweiterung der Herzkammern, haben Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim nun eine Ursache identifiziert: Ein niedriger Spiegel des Enzyms Ubiquitin-spezifische Peptidase 5 (USP5) führt zu einer Anhäufung von Ubiquitin in Herzmuskelzellen und zur Bildung von Proteinaggregaten, welche Herzerkrankungen auslösen. Die Erhöhung von USP5-Spiegeln in Herzmuskelzellen schützt das Herz vor schädlichen Umbauprozessen, was eine faszinierende Perspektive für neue Therapien bietet.
Unter einer dilatativen Kardiomyopathie (DCM) versteht man die krankhafte Erweiterung einer oder beider Herzkammern. Auch die Vorhöfe können betroffen sein. Die damit verbundene Einschränkung der Herzleistung wird durch eine strukturelle Schädigung der Herzmuskelzellen verursacht. Die Folge ist eine Herzschwäche, die im schlimmsten Fall ohne Herztransplantation zum Tode führt. Bislang existierende Therapiemöglichkeiten können das Fortschreiten der Erkrankung in der Regel nicht anhalten oder gar umkehren.
Auf der Suche nach neuen therapeutischen Wegen haben Wissenschaftler aus der Abteilung von Thomas Braun am Max-Planck-Institut für Herz- und Lungenforschung die molekularen Prozesse des Proteinabbaus in Herzmuskelzellen erforscht. Dabei stießen Yvonne Eibach und Silke Kreher, beide Erstautorinnen der Studie, zusammen mit ihren Forschungspartnern, auf Störungen in dem Prozess, welcher der Entsorgung defekter oder nicht mehr benötigter Proteine dient. Defekte oder nicht mehr benötigte Proteine werden mit Ketten eines Moleküls namens Ubiquitin verbunden und so für die Entsorgung markiert. Die Entsorgung findet in sogenannten Proteasomen statt, die einer zellulären Entsorgungsfabrik gleichkommen. Bevor die Proteine in diese Fabrik geschleust werden, werden die Ubiquitinketten wieder abgespalten und die Ketten müssen in ihre Einzelteile aufgespalten werden. Passiert dies nicht, kollabiert der ganze Müllverwertungsprozess. Verantwortlich für die Aufspaltung von Ubiquitinketten ist das Enzym Ubiquitin-spezifische Peptidase 5 (USP5), welches in Herzmuskelzellen in einer spezifischen Form vorkommt. Das Enzym ist entscheidend für das Recycling von Ubiquitin und garantiert somit ein Gleichgewicht zwischen dem Auf- und Abbau von Proteinen.
Die Bad Nauheimer Wissenschaftlerinnen stellten nun in Experimenten in einem Mausmodell fest, dass niedrige USP5-Spiegel eine dilatative Kardiomyopathie auslösen.
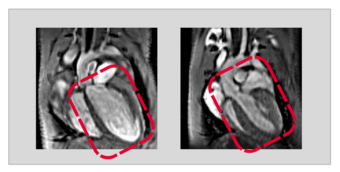
„Durch einen gentechnischen Eingriff konnten wir in den Herzmuskelzellen ausgewachsener Tiere USP5 gezielt ausschalten. Fehlte dann das USP5, entwickelte sich in der Folge eine dilatative Kardiomyopathie“, berichtet Silke Kreher. Co-Autorin Yvonne Eibach fügt hinzu: „Mit Hilfe der Magnetresonanztomographie als Bildgebungsverfahren konnten wir eindrucksvoll nachweisen, dass bei diesen Tieren das gesamte Herz deutlich vergrößert und die Pumpleistung stark eingeschränkt ist.“
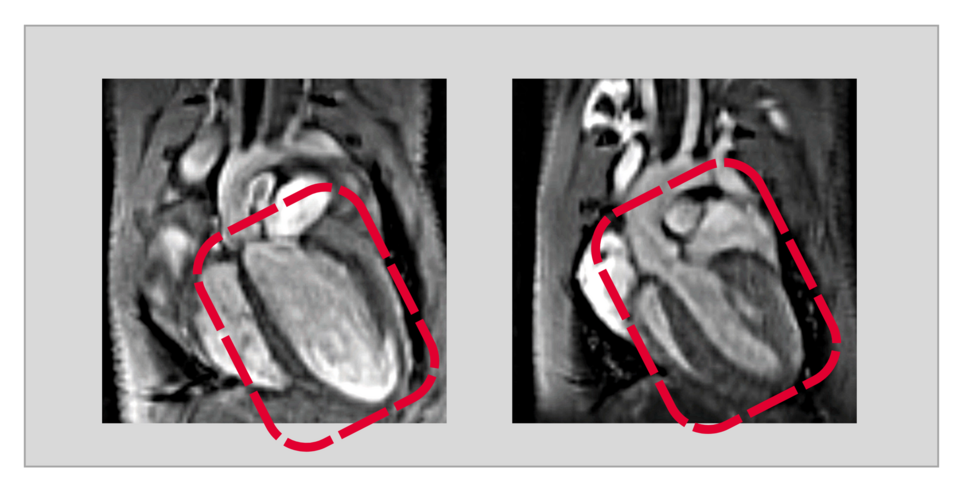
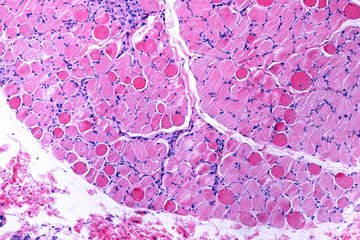
Unter dem Mikroskop stellten die Forscherinnen darüber hinaus vermehrt Proteinablagerungen fest, was eine direkte Folge des gestörten Abbaus von Proteinen ist, da diese ohne USP5 nicht mehr den Weg in die Proteasomen finden.
Weitere Experimente sollten die Wichtigkeit von USP5 bei Herzerkrankungen erhärten und der Frage nachgehen, ob durch erhöhte Produktion von USP5 therapeutische Verbesserungen erzielt werden können: „Wir haben durch einen gentechnischen Eingriff Herzmuskelzellen dazu gebracht, USP5 im Übermaß zu produzieren und dann die Tiere einer erhöhten Druckbelastung unterworfen“, so Kreher. Solch erhöhte Druckbelastungen finden sich etwa bei Bluthochdruck und bei Verengungen von Herzklappen. „Tiere mit erhöhter USP5 Produktion kamen wesentlich besser mit der erhöhten Druckbelastung zurecht und zeigten deutlich weniger schädliche Umbauprozesse im Herzen. Letztlich ging es den Tieren entscheidend besser als den Kontrolltieren“, ergänzt Eibach.
Von besonderem Interesse war für die Bad Nauheimer Forscher, die klinische Relevanz der Erkenntnisse beurteilen zu können. „Hierfür untersuchten wir Herzbiopsien von Patienten mit einer DCM, welche unter anderem von der benachbarten Kerkhoff-Klinik zur Verfügung gestellt wurden“, so Eibach. „Und tatsächlich stellten wir fest, dass in Herzen von DCM-Patienten der USP5 Spiegel wesentlich reduziert war. Auch die bereits in den Mäusen beobachteten Proteinaggregate konnten wir in den kranken Herzmuskelzellen bei Patienten finden.“, erklärt Kreher.
Abteilungsdirektor Thomas Braun fasst die Daten so zusammen: „Unsere Studie rückt erstmals die Rolle des Recyclings von Ubiquitinketten bei der dilatativen Kardiomyopathie in den Vordergrund, für welches USP5 essentiell ist“. Die Bad Nauheimer Forscher hoffen, dadurch auch neue therapeutische Optionen zu finden: „Wir nehmen an, dass eine Hemmung des Abfalls von USP5 oder auch eine therapeutische Erhöhung der USP5 Konzentration in Herzmuskelzellen die Aggregation von Proteinen reduzieren wird und damit das Fortschreiten der Erkrankung zumindest bremsen wird“, so Braun.
Diese Arbeit wurde unterstützt durch den Exzellenzcluster Cardio Pulmonary System (CPI), den DFG-Sonderforschungsbereich 267 (TP A05), die DFG-Sonderforschungsbereiche 1213 (TP A02 und B02) und 1531 (TP B08), das DFG-Graduiertenkolleg GRK2355 (Projektnummer 325443116), das Deutsche Zentrum für Herz-Kreislauf-Forschung. Weitere Unterstützung erfolgte durch die British Heart Foundation (CH/08/001 und RG/F/22/110079) und das Medical Research Council (MR/R003106/1), sowie durch die Leibniz-Stiftung.