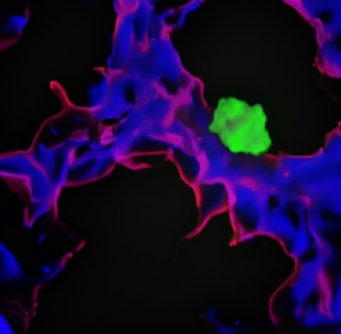
Protein in Blutgefäßen versetzt Tumorzellen in Tiefschlaf
Membranprotein PEAR1 verhindert Entstehung von Metastasen
Einige Krebspatienten entwickeln nach mehreren tumorfreien Jahren erneut Metastasen. Ursache sind oft einzelne Tumorzellen, die in einem Ruhestadium im Gewebe in der Nähe kleiner Blutgefäße angesiedelt sind. Plötzlich durchlaufen diese Zellen wieder die Zellteilung und bilden Metastasen. Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung analysierten nun mehr als 500 Gene in einem Screeningverfahren. Dabei identifizierten sie ein Gen, dessen als PEAR1 bezeichnetes Genprodukt in der Membran von Blutgefäßzellen liegt und für den Ruhezustand der Tumorzellen verantwortlich ist. Fehlt das Protein, beginnen sich die Tumorzellen wieder zu teilen.
Dank medizinischer Fortschritte haben sich die Heilungschancen vieler Tumorerkrankungen verbessert. Jedoch sterben einige Patienten nicht am Primärtumor, sondern an spät auftretenden Metastasen – oft viele Jahre nach erfolgreicher Behandlung. Ein bisher weitgehend ungelöstes Problem besteht darin, dass metastasierte Tumorzellen sich nach ihrer Streuung über viele Jahre in anderen Organen eingenistet haben, dort aber zunächst inaktiv bleiben. Dieses Phänomen bezeichnet man als Tumor-Dormanz. Die „schlafenden“ („dormanten“) Tumorzellen können teilweise sehr viel später wieder aktiv werden und erneut mit der Zellteilung beginnen. Ausgehend von diesen einzelnen Tumorzellen entstehen so Metastasen. Klinisch relevant ist das Phänomen beispielsweise bei Brustkrebs, Prostatakarzinom und Melanomen.
Welche Mechanismen diesem Tumorzellschlaf zugrunde liegen und wie es dabei zu einer Reaktivierung schlafender Tumorzellen kommt, war bislang weitgehend unbekannt. Wissenschaftler aus der Abteilung von Stefan Offermanns, Direktor am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim, haben nun ein Protein entdeckt, das den Wiedereintritt der Tumorzellen in die Zellteilung verhindert.
„Es ist bekannt, dass schlafende Tumorzellen den normalen Zellzyklus verlassen und in die sogenannte G0-Phase übergehen, in der sie sich nicht mehr teilen. Schlafende Tumorzellen halten sich insbesondere in der Wand kleiner Blutgefäße verschiedener Organe auf und haben intensiven Kontakt mit den Zellen der inneren Gefäßwand, den Endothelzellen“,
erklärt Kenneth A. Roquid, Erstautor der Studie. Die Bad Nauheimer Wissenschaftler vermuteten, dass das Mikromilieu dieser Nischen die Tumorzellen inaktiviert, wohingegen eine Störung dieses Milieus z.B. durch eine Entzündung oder Verletzung ein erneutes Wachstum der Tumorzellen auslöst.
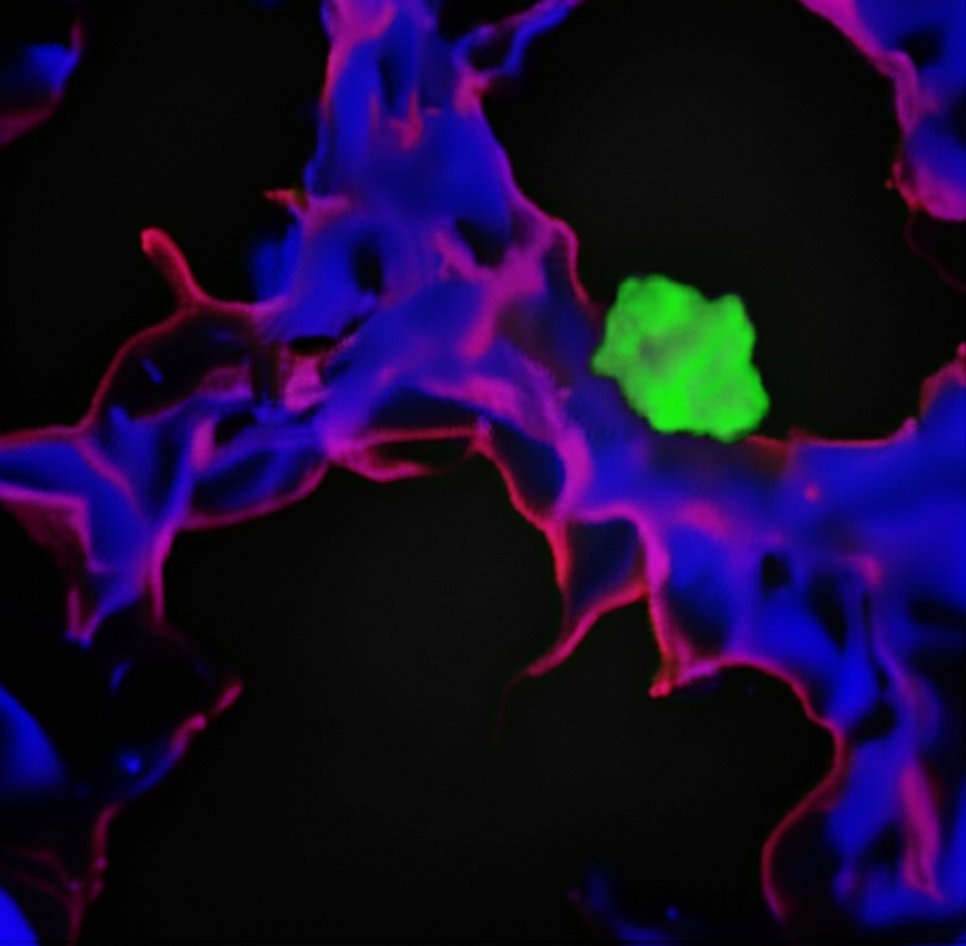
„Im ersten Schritt entwickelten wir ein Zellkultur-Testsystem, in dem wir Endothelzellen und schlafende Tumorzellen gemeinsam kultivieren konnten. Anschließend schalteten wir dann systematisch über 500 Gene in Endothelzellen aus“, so Roquid. Diese Gene kodierten für Proteine auf der Oberfläche von Endothelzellen oder für Proteine, die von Endothelzellen freigesetzt werden. „In unserem Testsystem untersuchten wir anschließend, ob durch das Ausschalten eines Gens die Dormanz der Tumorzellen verloren ging“, so Roquid weiter. Letztlich identifizierten die Max-Planck-Forscher mit PEAR1 ein Protein, das in der Plasmamembran der Endothelzellen sitzt und Tumorzellen in der Dormanz hält.
Im nächsten Schritt testete Offermanns‘ Team die Entdeckung im lebenden Organismus: „In Mäusen, bei denen die Expression von PEAR1 selektiv in Endothelzellen unterbunden war, beobachteten wir deutlich mehr Metastasen als in der Kontrollgruppe“, fasst Ko-Autorin Adriana Vucetic die Befunde zusammen. Den Mechanismus erklärt sie folgendermaßen: „Zwei weitere Proteine, als LOXL2 und CTSD bezeichnet, verhindern normalerweise den Tumorzellschlaf. Wenn LOXL2 und CTSD reduziert sind, dann verstärkt sich die Dormanz und es bilden sich in den Mäusen weniger Metastasen“, so Vucetic. Die Bad Nauheimer Wissenschaftler zeigten nun, dass PEAR1 an diese beiden Proteine bindet, sie inaktiviert und so die Tumordormanz fördert. Fehlt PEAR1, sind LOXL2 und CTSD aktiv, so dass mehr Metastasen entstehen.
„Unsere Ergebnisse zeigen, dass das Oberflächenprotein PEAR1 für ein stabiles Mikromilieu im Umfeld kleiner Blutgefäße sorgt. Auf diese Weise trägt es entscheidend dazu bei, Tumorzellen in einem schlafenden Zustand zu halten“,
erklärt Offermanns.
„Dieser Mechanismus könnte langfristig neue Möglichkeiten eröffnen, späte Metastasen zu verhindern.“
Vor einer klinischen Anwendung halten es die Bad Nauheimer Forscher jedoch für notwendig, weitere Komponenten dieses die Tumor-Dormanz fördernden Mikromilieus zu entschlüsseln und so das grundlegende Verständnis noch weiter zu verbessern.