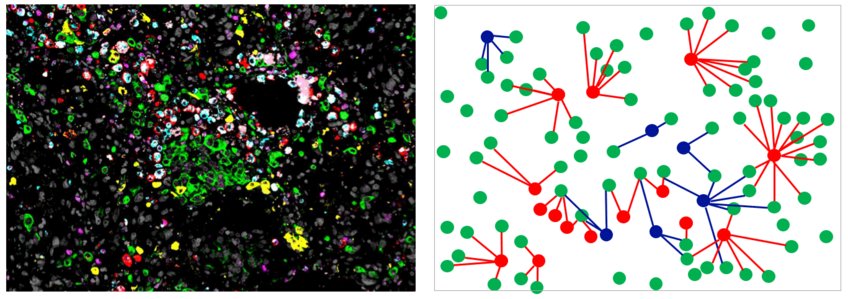
Rudelbildung am Tumorherd
Anzahl von Fresszellen im Tumorgewebe ermöglicht Verlaufsprognose bei Lungentumoren
Sowohl am Rand von Lungentumoren als auch im Zentrum des Tumors selbst findet man häufig charakteristische Ansammlungen bestimmter weißer Blutkörperchen, sogenannter Makrophagen, als Tumor-assoziierte Makrophagen bezeichnet. Dabei existieren zwei Populationen mit gegensätzlicher Wirkung auf den Tumor: Während die einen tumorfördernd sind, hemmt die zweite Makrophagen-Population das Krebswachstum. Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung und der Justus-Liebig-Universität in Gießen konnten nun zeigen, dass Lage und Dichte der beiden Zellpopulationen im Tumorgewebe eine Vorhersage über den Verlauf der Erkrankung ermöglichen. Hieraus werden neue therapeutische Möglichkeiten erwachsen.
Immunzellen beeinflussen den Verlauf von Tumoren maßgeblich. Dabei können sie das Tumorwachstum je nach Zelltyp sowohl fördern als auch hemmen. Dies gilt insbesondere für eine Gruppe von Makrophagen, die sich im Tumorzentrum oder den Randbereichen in teilweise hoher Zahl ansammeln. Je nach Aktivierungszustand können diese sogenannten Tumor-assoziierten Makrophagen den Verlauf der Erkrankung positiv oder negativ beeinflussen.
Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung und der Justus-Liebig-Universität in Gießen deckten auf, dass aus der Ansammlung einer Subpopulation der Tumor-assoziierten Makrophagen in einem bestimmten Areal Rückschlüsse über den weiteren Verlauf der Tumorerkrankung getroffen werden können. Rajkumar Savai, Projektleiter in der Abteilung „Entwicklung und Umbau der Lunge“ und Mitglied im Zentrum für Innere Medizin der Justus-Liebig-Universität erklärt: „Man kann bei Lungentumoren in der Regel das Zentrum des Tumors vom Randareal abgrenzen. Weil dort besonders viele Immunzellen einwandern, bezeichnen wir dieses Gebiet als invasiven Tumorrand.“
Für ihre Studie verwendeten die Forscher eine aufwändige Mikroskopiertechnik, die sogenannte Multiplex-Immunfluoreszenzmikroskopie. Die dadurch eindeutig identifizierbaren Makrophagen unterzogen sie einer Analyse ihrer jeweiligen Entfernung zu benachbarten Tumorzellen. Zusätzlich teilten die Max-Planck-Forscher teilten anhand bestimmter Eigenschaften die Zellen in tumorfördernde und tumorhemmende Tumor-assoziierte Makrophagen ein. „Wir stellten fest, dass vor allem im invasiven Randbereich des Tumors mehr tumorfördernde Zellen zu finden waren als tumorhemmende. Zudem lagen diese näher bei den Tumorzellen“, so Savai. „Anhand von Gewebeproben von mehr als hundert Patienten konnten wir dann ein Muster erkennen.“ Demnach war die Überlebensrate bei Lungenkrebspatienten insbesondere dann geringer, wenn die tumorfördernden Makrophagen in den invasiven Randbereichen besonders eng an den Tumorzellen lagen und gleichzeitig tumorhemmende Makrophage weiter entfernt waren.
Auch die Zellzahl hatte einen Einfluss auf die Prognose der Patienten: „Wenn im Zentrum des Tumors weniger tumorhemmende Makrophagen vorhanden waren, hatten die Patienten eine geringere Überlebenswahrscheinlichkeit. Insgesamt fanden wir mehr tumorfördernde als tumorhemmende Makrophagen“, so Savai.
Dass tumorfördernde und tumorhemmende Makrophagen tatsächlich unterschiedliche Aktivitätsmuster besitzen, zeigte sich, als die Bad Nauheimer Wissenschaftler die RNA der Zellen sequenzierten. „Wir stellten bei den beiden Zellvarianten, auch im Vergleich mit Makrophagen von außerhalb der Tumorgewebe, stark unterschiedliche Genexpressions-Profile fest“, Savai. Dabei identifizierten die Forscher auch fünf Kandidaten für Biomarker, mit deren Hilfe sich die Überlebenswahrscheinlichkeit bei Lungenkrebs vorhersagen lassen könnte. „Diese Biomarker könnten sich für die individuelle Behandlungsstrategie der Lungenkarzinompatienten als sehr hilfreich erweisen“, betont Friedrich Grimminger, Leiter des Gießener Lungentumorzentrums und Direktor der Medizinischen Klinik IV/V der Justus-Liebig-Universität.
„Wir haben, basierend auf charakteristischen Genexpressionsprofilen der Tumor-assoziierten Makrophagen, in dieser Studie zudem Faktoren identifiziert, die sich als neue Zielstrukturen für spezifische Therapieansätze anbieten“, ergänzt Werner Seeger, Direktor der Abteilung „Entwicklung und Umbau der Lunge“ am Max-Planck-Institut und der Medizinischen Klinik II der Justus-Liebig-Universität.
MH
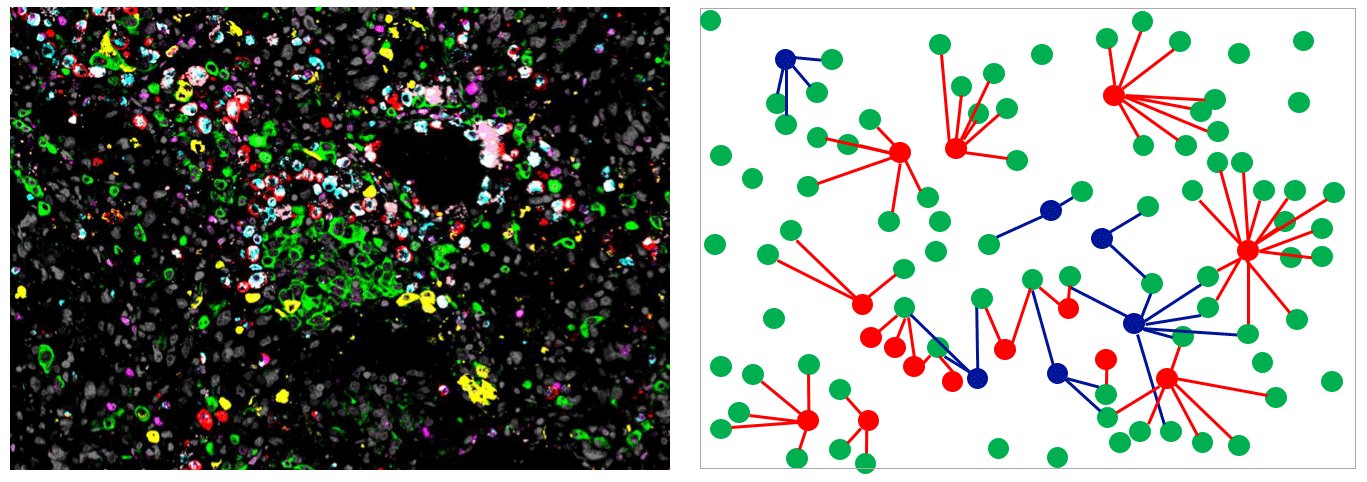
Komplexe Nachbarschaftsbeziehungen. Die mittels der sogenannten Multiplex-Immunfluoreszenzmikroskopie sichtbar gemachten Tumorzellen und unterschiedlichen Makrophagenpopulationen (links) wurden einer aufwändigen Lageanalyse unterzogen (rechtes Schema). Im Schema sind Tumorzellen grün, tumorhemmende Makrophagen blau und tumorfördernde Makrophagen rot dargestellt.