Proteinschalter in Blutgefäßen verstärkt Schäden bei Gefäßerkrankungen
GPR153 fördert als Reaktion auf akute Schäden der Gefäße entzündliche Reaktionen in deren Wand
Nach einer Schädigung von Blutgefäßen können die Heilungsprozesse außer Kontrolle geraten und selbst krankhaft werden, beispielsweise bei der Arteriosklerose. Forscher des Max-Planck-Instituts für Herz- und Lungenforschung haben nun gezeigt, dass GPR153, ein Protein aus der Gruppe der G-Protein-gekoppelten Rezeptoren, wesentlich dafür verantwortlich ist. Im Falle eines Gefäßschadens wirkt das Protein als Schalter für eine entzündliche Aktivierung und verstärkt damit den Schaden. GPR153 könnte deshalb ein Anknüpfpunkt für eine Therapie sein, mit deren Hilfe Erkrankungen im Gefäßsystem abgemildert werden könnten.
G-Protein-gekoppelte Rezeptoren sind eine große Gruppe von Proteinen, die an der Regulation einer Vielzahl zellulärer Prozesse beteiligt sind. Dabei sind sie wesentlich für die Kommunikation zwischen Zellen und innerhalb von Zellen verantwortlich. Nicht wenige dieser Rezeptoren sind zwar als Molekül bekannt, man weiß bislang jedoch nicht, welche Funktion sie tatsächlich ausüben. Eines dieser als Orphan-Rezeptor bezeichneten Moleküle ist GPR153. Das Protein kommt in der Zellmembran sowohl in den glatten Muskelzellen der Gefäßwand als auch in der innersten Zellschicht, als Endothelzellen bezeichnet, vor. Der Arbeitsgruppe von Nina Wettschureck vom Max-Planck-Institut für Herz- und Lungenforschung ist es nun gelungen, die Funktionsweise des Proteins zu entschlüsseln.
Zunächst stellten die Max-Planck-Forscher an Mäusen mit unterschiedlichen Verletzungen der Gefäßwände fest, dass als Folge dieser Schädigungen die Produktion des Rezeptors in den Zellen hochgefahren wird. Analog dazu fand das Forscherteam in Probenmaterial von Patienten mit Arteriosklerose erhöhte GPR153-Werte. „Wir werteten dies als deutlichen Hinweis darauf, dass GPR153 eine Rolle bei Verletzungen der Gefäßwand spielt“, so Jingchen Shao, Erstautor der Studie.
Nach einer Verletzung laufen in der Gefäßwand charakteristische Prozesse ab: In den Endothelzellen kommt es zu einer entzündlichen Aktivierung. Dies lockt verstärkt Immunzellen an. Die Verletzung des Endothels wirkt sich auch auf die benachbarten Glattmuskelzellen aus. Sie beginnen zu teilen beginnen und wandern in Richtung des Endothels. So kann eine neue Schicht in der Gefäßwand entstehen, die sogenannte Neointima.
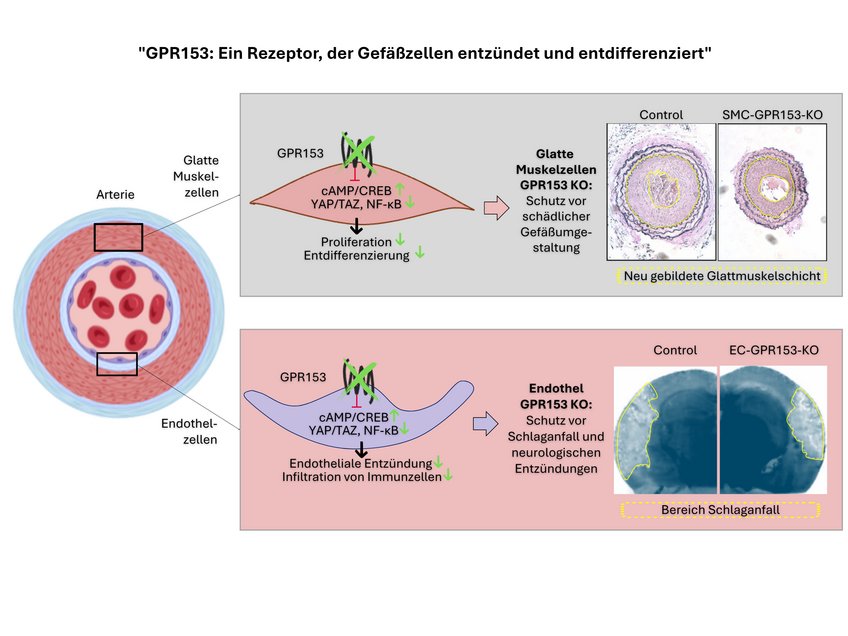
„Unsere Studie zeigt nun, dass GPR 153 ein wichtiger Schalter für diese Prozesse ist, und zwar in negativer Hinsicht“
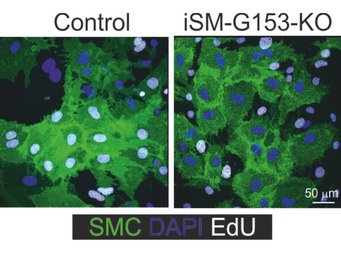
so Shao. In Mäusen, denen GPR153 in Glattmuskelzellen fehlt, ist das Wachstum der Glattmuskelzellen nach Schädigung deutlich reduziert und die Neointimabildung dementsprechend vermindert.
„Umgekehrt bedeutet dies, dass GPR153 die Schädigung der Gefäßwand vorantreibt und verstärkt“,
sagt Shao.
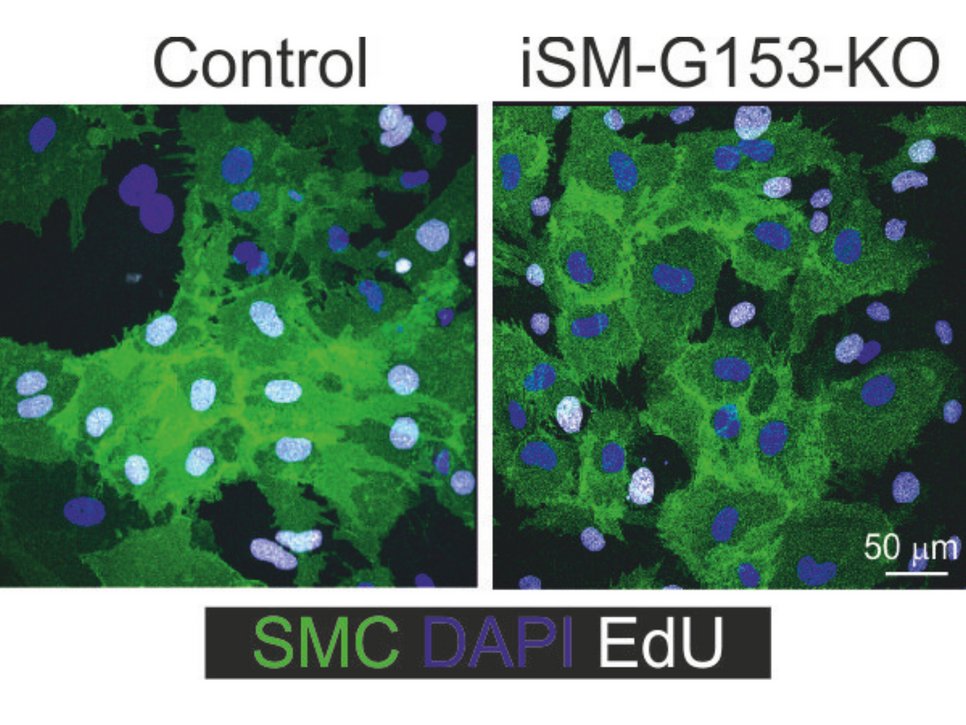
In weiteren Experimenten zeigten die Bad Nauheimer Forscher, wie GPR153 dabei auf molekularer Ebene vorgeht: Im Fokus steht dabei ein Botenstoff in den Zellen, das cAMP. GPR153 bremst dessen Produktion; fehlt GPR153, entwickelt sich ein wesentlich höherer cAMP-Spiegel. Das hat Folgen für die Zellen und die Schädigung der Gefäßwand: „Auf der einen Seite werden Signalwege, die die Zellen eher schützen, aktiver. Auf der anderen Seite bremst ein hoher cAMP-Spiegel die Signalwege ab, die Entzündungsreaktionen verstärken und die Zellteilung anheizen“, erklärt Nina Wettschureck, Gruppenleiterin am Max-Planck-Institut und Leiterin der Studie.
Interessanterweise finden sich ganz ähnliche Effekte, wenn GPR153 in Endothelzellen ausgeschaltet wird: Durch die verminderte entzündliche Aktivierung haften weniger Immunzellen am Endothel und wandern weniger in das Gewebe ein. Dies dämpft die Entzündungsreaktion und begrenzt damit den Schaden. Mäuse, bei denen GPR153 gezielt in den Endothelzellen des Gehirns ausgeschaltet wurde, zeigten in Modellen für Multiple Sklerose und Schlaganfall beeindruckende Verbesserungen im Vergleich zu Kontrolltieren: „Wir stellten im Gehirn dieser Mäuse weniger Entzündungsherde fest, es waren weniger Immunzellen eingewandert und die Tiere waren neurologisch weniger auffällig“, fasst Shao die Daten zusammen.
Aus Sicht der Max-Planck-Forscher weisen die Erkenntnisse der Studie auf neue therapeutische Anknüpfpunkte hin.
„Unsere Daten zeigen, dass GPR153 ein Verstärker für schädigende Prozesse in verletzten Blutgefäßen ist. Deshalb ist der nächste Schritt Wege zu untersuchen, wie man die Produktion bei einer Gefäßschädigung gezielt hemmen oder die Aktivität des Proteins blockieren kann,“ sagt Wettschureck.
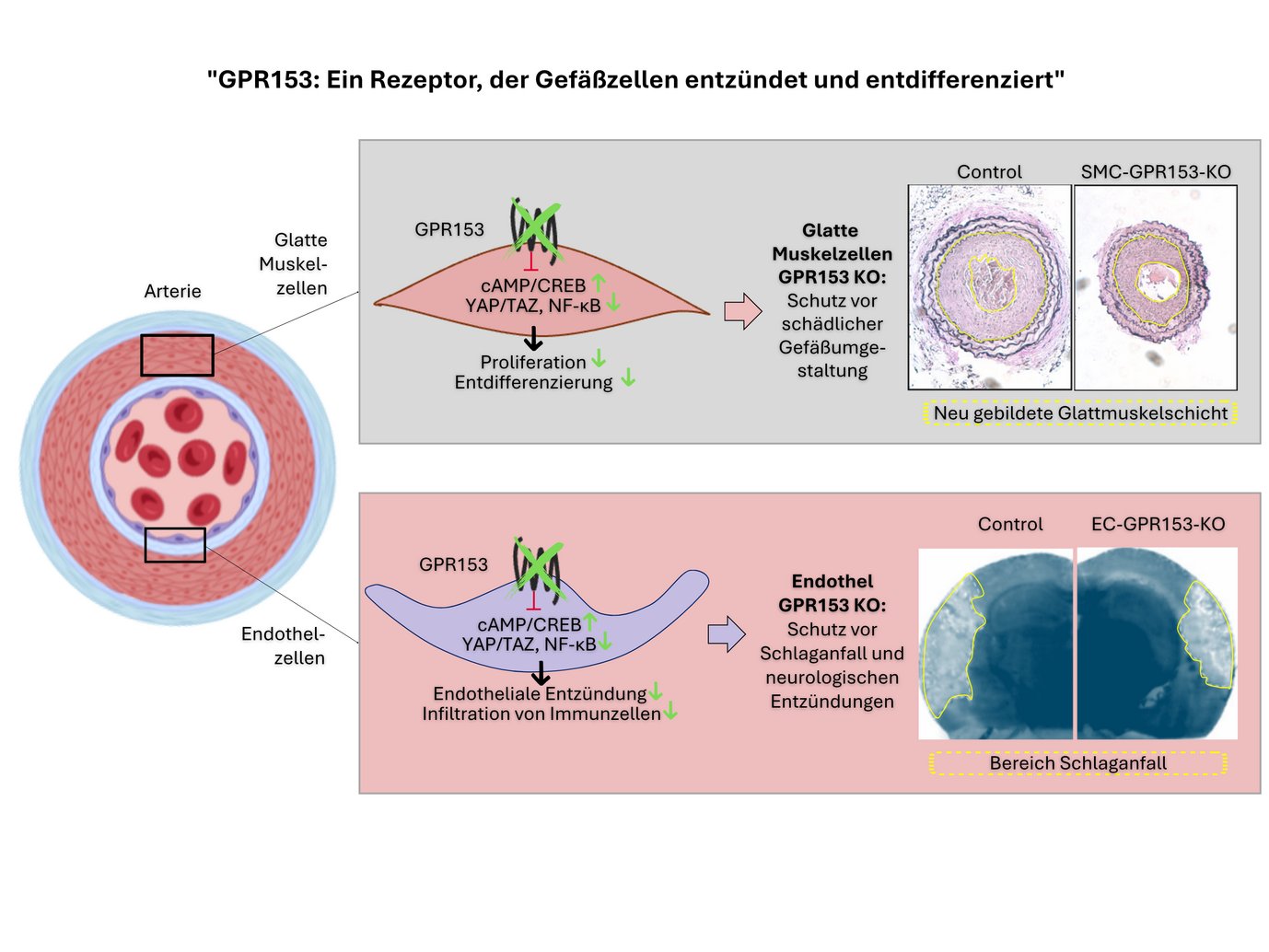
Die zelltypspezifische Inaktivierung von GPR153 (grünmarkiert) verhindert die Entdifferenzierung glatter Muskelzellen und die Entzündung des Endothels. Infolgedessen sind zelltypspezifische Knockout-Mäuse in Krankheitsmodellen wie Neointimabildung, Schlaganfall oder Multipler Sklerose geschützt.
Zusammenfassend lässt sich sagen, dass GPR153 ein interessantes Ziel für die parallele Hemmung der Endothelentzündung und der Entdifferenzierung glatter Muskelzellen ist.