Komplexe Steuerungsprozesse für ein komplexes Organ: Wie zwei verwandte Proteine zusammenarbeiten um die Entwicklung des Herzens zu steuern.
RBPMS und RBPMS2 regulieren Zellteilung und -funktion während der Herzentwicklung
Forscher des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim haben entscheidende Mechanismen aufgedeckt, welche die embryonale Herzentwicklung regulieren. Die Studie zeigt, dass zwei engverwandte RNA-bindende Proteine, RBPMS und RBPMS2, eine entscheidende Rolle bei der Steuerung des Spleißens herzspezifischer RNAs spielen. Eine Störung dieses Prozesses führt zu schweren strukturellen Fehlbildungen und arretiert die Herzentwicklung vor der Geburt. Diese Ergebnisse wurden kürzlich in der Fachzeitschrift Developmental Cell veröffentlicht.
Während der Entwicklung des Embryos durchläuft das Herz kritische molekulare und strukturelle Veränderungen, die es für eine lebenslange Schwerstarbeit fit machen. Nach der Geburt stoppt die Vermehrung der Herzzellen und es werden zusätzliche Zellkerne gebildet. Gleichzeitig werden die kontraktilen Einheiten, die Sarkomere, innerhalb der Herzmuskelzellen steifer. Störungen oder Fehler in diesem Reifungsprozess sind häufig mit angeborenen Herzfehlern verbunden. Um diese zu verhindern, ist ein detailliertes Verständnis der molekularen Mechanismen, die der Reifung von Herzzellen zugrunde liegen, unerlässlich.
Ein Schlüsselprozess für die Herzentwicklung ist das alternative Spleißen, bei dem die von Genen kopierten primären RNA-Transkripte unterschiedlich verarbeitet werden, wodurch verschiedene reife RNAs entstehen. RNA-bindende Proteine spielen dabei eine entscheidende Rolle, indem sie an spezifische Stellen der RNA binden und so deren Spleißen regulieren. Diese Regulation führt zur Entstehung mehrerer ähnlich gebauter Proteine, als Isoformen bezeichnet. Dieser Prozess erhöht die Vielfalt der in der Zelle verfügbaren Proteine, des Proteoms.
Forscher aus der Abteilung von Thomas Braun am Max-Planck-Institut für Herz- und Lungenforschung haben bedeutende Fortschritte beim Verständnis der Herzentwicklung erzielt, indem sie zwei engverwandte RNA-bindende Proteine, RBPMS und RBPMS2, untersucht haben. Bei beiden handelt es sich um Spleißfaktoren, das heißt, sie greifen in das alternative Spleißen ein.
„Zunächst haben wir Mäuse untersucht, denen genetisch nur einer der beiden Spleißfaktoren der RBPMS/RBPMS2-Familie fehlt. Bemerkenswerterweise zeigten die Mäuse trotz der Inaktivierung von RBPMS eine normale Herzentwicklung und normale Herzfunktion nach der Geburt“, sagt Shan Lin, Erstautor der Studie. Als Nächstes inaktivierte Shan auch RBPMS zusammen mit RBPMS2, was zu schweren Defekten bei der Herzentwicklung und dessen Funktion führte. „Die gleichzeitige Inaktivierung von RBPMS und RBPMS2 hat uns gezeigt, dass der Verlust eines Gens während der Herzentwicklung durch andere Gene kompensiert werden kann“, erklärt Lin.
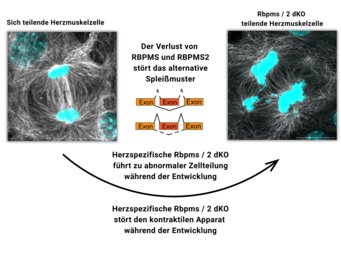
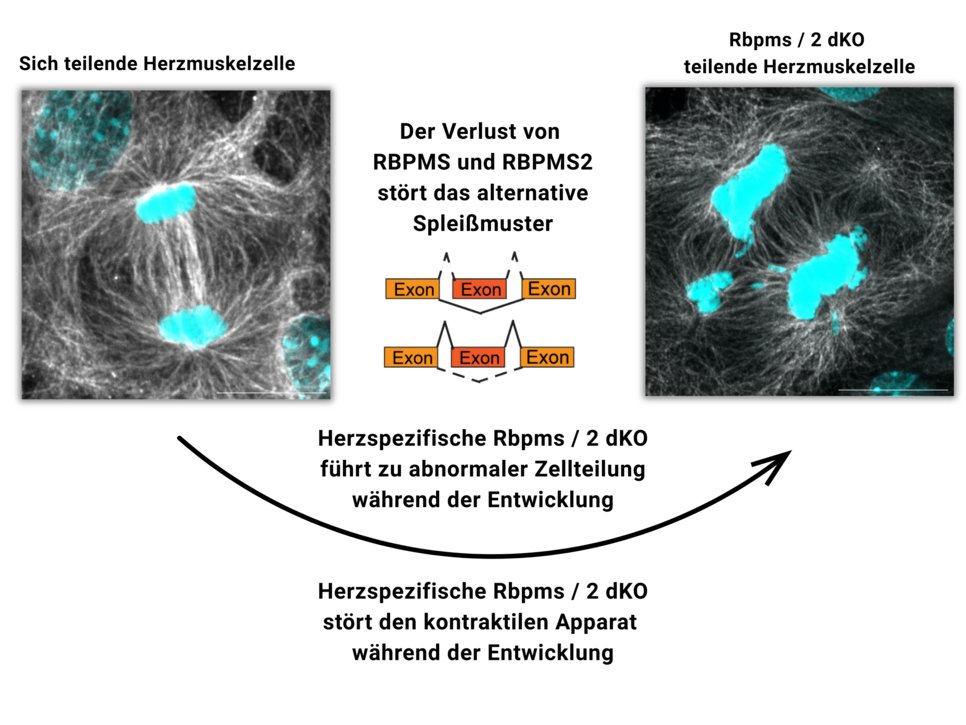
Aber welche molekularen Prozesse werden durch Spleißproteine gesteuert? „Unsere Studien haben gezeigt, dass RBPMS und RBPMS2 eine Schlüsselrolle bei mehreren grundlegenden Prozessen der Herzentwicklung spielen”, so Lin. Die Gruppe entdeckte, dass RBPMS und RBPMS2 nicht nur die Bildung von Isoformen für Proteine des Sarkomers steuern, sondern auch die Bildung des Spindelapparats regulieren, der für die Zellteilung unerlässlich ist. „Wenn beide Proteine inaktiv sind, ist die Zellteilung gestört“, erklärt Lin.
Das Forschungsteam untersucht nun das Zusammenspiel von RBPMS und RBPMS2 mit anderen Spleißfaktoren, die als Ursachen für eine Kardiomyopathie bei menschlichen Patienten bekannt sind.
„Langfristig könnte dies den Weg für neue therapeutische Strategien ebnen“, sagt Thomas Braun, Direktor der Abteilung für Herzentwicklung und Remodellierung. „Durch ein tieferes Verständnis der zugrunde liegenden Ursachen werden künftig RNA-basierte Therapien zur Wiederherstellung oder Modulation der durch RBPMS und RBPMS2 regulierten Prozesse möglich sein, die eine gezielte Behandlung von Entwicklungsstörungen mit angeborenen Herzfehlern ermöglichen.“