mikroRNAs regulieren essenzielle Funktionen im kardiovaskulären System
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Herz- und Lungenforschung - W. G. Kerckhoff-Institut
Die primäre Funktion von mikroRNAs (miRNAs) besteht darin, die Genexpression von spezifischen Zielproteinen posttranskriptionell zu unterdrücken. Die funktionelle Analyse von miRNA-Funktionen in vivo ermöglicht faszinierende Einblicke in komplexe Regulationsvorgänge. Eine Arbeitsgruppe am MPI für Herz- und Lungenforschung untersucht, wie miRNAs molekulare Regulationsvorgänge in den kontraktilen Zellen des kardiovaskulären Systems vermitteln. Die Arbeiten geben auch Aufschluss über die Entwicklung und Physiologie des Herz-Kreislauf-Systems.
MikroRNAs (miRNAs) sind kurze, nicht kodierende RNAs, welche regulierend in viele biologische Prozesse eingreifen. Ein Ziel der Arbeitsgruppe von Thomas Böttger ist es, die Funktionen von miRNAs im kardiovaskulären System genauer zu bestimmen. miRNAs sind im Genom kodierte RNA-Moleküle, die zunächst als längere Precursor-RNA-Moleküle transkribiert werden. Durch Prozessierung dieses Precursors über den bereits sehr gut untersuchten Drosha/DGCR8-Dicer-Mechanismus entstehen reife, zirka zwanzig Nukleotide lange miRNA-Moleküle, welche posttranskriptionell die Expression von Proteinen unterdrücken (reprimieren) können.
Die Spezifität dieser Regulation ist durch die Komplementarität zwischen miRNA und Sequenzbereichen der Protein-kodierenden messengerRNAs (mRNAs) bestimmt. Darunter versteht man, dass die Nukleotide der RNA-Stränge in bestimmten Bereichen über die komplementären Basenpaare zusammenpassen. Dabei ist jedoch keine komplette Komplementarität zwischen miRNA und mRNA erforderlich, vielmehr ist für eine regulatorische Interaktion zwischen miRNA und mRNA nur eine partielle Komplementarität notwendig. Die Interaktion von miRNA und mRNA wird durch weitere Bedingungen wie beispielsweise die Konzentration und Konformation der Zielmoleküle, RNA-bindende Proteine oder auch durch andere, im Einzelfall weniger gut untersuchte Faktoren festgelegt. Während sich aufgrund der partiellen Komplementarität zwischen miRNA und mRNA potenzielle Zielgene relativ einfach ermitteln lassen, ist die tatsächliche Interaktion aufgrund der Komplexität des zellulären Kontexts nur im jeweiligen physiologisch relevanten zellulären System bestimmbar. Außerdem hat nicht jede regulatorische Interaktion in einem spezifischen physiologischen Kontext eine fassbare Auswirkung auf das Gesamtsystem.
Daher ist die Untersuchung der miRNA-Funktion im physiologisch relevanten Kontext unumgänglich. Ein wichtiges Mittel für die Untersuchung physiologisch relevanter Regulationsvorgänge sind somit in vivo durchgeführte loss-of-function-Studien. Die Arbeitsgruppe am MPI für Herz- und Lungenforschung konzentriert sich mit ihren funktionellen Analysen auf miRNAs, die spezifisch und in großer Menge in den kontraktilen Zellen des kardiovaskulären Systems exprimiert werden.
Das miR-143/145-Cluster bestimmt den Phänotyp vaskulärer glatter Muskelzellen
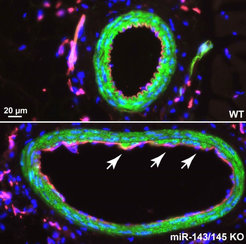
Die miRNAs miR-143 und miR-145 werden in hoher Konzentration und Spezifität in den glatten Muskelzellen der Blutgefäße exprimiert. Die beiden miRNAs sind im Genom der Säugetiere eng benachbart lokalisiert und werden als Bestandteil einer gemeinsamen Precursor-RNA transkribiert. Nach Prozessierung der Precursor-RNA entstehen zwei separate, reife miRNA-Moleküle, die teilweise überlappende Funktionen ausüben. Die Generierung von miR-143 und miR-145 aus einer Precursor-RNA legt nahe, beide Moleküle als eine regulatorische Einheit zu betrachten. Die Deletion der beiden miRNAs im Genom der Maus ermöglichte den Wissenschaftlern einen Einblick in die Bedeutung der miRNAs für die Funktion der glatten Muskelzellen der Blutgefäße und die zugrundeliegenden regulatorischen Prozesse. So führt die Deletion des miRNA-Clusters zu vermindertem Blutdruck, welchen die Forscher auf verminderte basale und Agonist-induzierte Kontraktilität der Blutgefäße zurückführen konnten.
Betroffen sind dabei sowohl die durch adrenerge Stimulation induzierte Kontraktilität, als auch die durch Angiotensin-II-induzierte Kontraktion der Blutgefäße. Weiterhin beobachteten die Forscher die Ausbildung arteriosklerotischer Veränderungen in den Blutgefäßen der Tiere, die miR-143/145 nicht mehr exprimierten (Knockout-Mäuse). Im Gegensatz zu sonst üblichen Modellen von Arteriosklerose in der Maus wurden diese Veränderungen nicht durch erhöhte Blutfettwerte ausgelöst, sondern sie beruhten offensichtlich primär auf der Migration von glatten Muskelzellen in eine sich dann bildende krankhaft verdickte innere Blutgefäßwand (Neointima) (Abb. 1).

Basierend auf Analysen des Proteoms und des Transkriptoms identifizierten Böttger und sein Team ein Set von direkt durch miR-143/145 regulierten Proteinen, wobei die durch miR-145 vermittelte Repression des angiotensin converting enzyme (ACE) von besonderer Bedeutung für die Funktion der vaskulären glatten Muskelzellen (VSMCs) ist. Die Arbeit der Max-Planck-Forscher belegt, dass die Repression von ACE durch miR-145 in vivo essenziell für die Sensitivität von VSMCs gegenüber den Kontraktion-induzierenden und Blutdruck-regulierenden Agonisten ist. Vermehrte Aktivität von ACE in glatten Muskelzellen ist auch ein Auslöser für ihre phänotypische Veränderung und die beobachtete Arteriosklerose (Abb. 2). Die bisherigen Arbeiten identifizierten weitere interessante Zielmoleküle von miR-143/145, deren Regulation bedeutsam für die Funktion der vaskulären glatten Muskelzellen ist und deren Funktion die Wissenschaftler gegenwärtig untersuchen.
Die miR-1/133-Cluster sind essenziell für die Entwicklung des embryonalen Herzens
Die miRNAs miR-1 und miR-133 gehörten zu den ersten in Säugetieren identifizierten miRNA-Molekülen; dennoch ist ihre physiologische Bedeutung bisher nur unvollständig verstanden. Die beiden miRNAs sind im Genom in zwei miR-1/133-Clustern kodiert und beide Cluster sind spezifisch in Herzmuskelzellen (Kardiomyozyten) und Skelettmuskelzellen exprimiert. Dabei ist die miRNA miR-1 die in diesen beiden Zelltypen häufigste miRNA, ca. 80 Prozent der gefundenen miRNAs sind miR-1-Moleküle.
Die Deletion nur eines der beiden miR-1/133-Cluster aus dem Genom der Maus zeigt, dass die miRNA-Cluster im erwachsenen Herzen an der Modulation der elektrophysiologischen Eigenschaften der Kardiomyozyten beteiligt sind. Die Verringerung der Menge an miR-1/133 führt zur Ausbildung eines sog. Long-QT-Syndroms, welches beim Menschen Ursache des plötzlichen Herztodes sein kann. Die Deletion beider miR-1/133-Cluster führt zum Komplettverlust von miR-1/133 und zeigt, dass diese beiden miRNAs unerlässlich für definierte Differenzierungsschritte bei der embryonalen Herzentwicklung sind. Es ist seit langem bekannt, dass das Herz in frühen Embryonalstadien durch eine ausgeprägte Expression von Proteinen charakterisiert ist, die eigentlich für glatte Muskelzellen spezifisch ist. Die Expression dieser Proteine wird in der weiteren embryonalen Entwicklung massiv zugunsten von Kardiomyozyten-spezifischen Proteinen reduziert.
Die MPI-Wissenschaftler konnten zeigen, dass die miRNAs miR-1/133 im embryonalen Herzen wesentlich für die Repression der sonst für glatte Muskelzellen spezifischen Proteine verantwortlich sind. Durch direkte Interaktion zwischen miRNA und Protein-kodierender mRNA reprimiert miR-1 die Expression des Transkriptionsfaktors Myocardin und begrenzt so die durch Myocardin vermittelte transkriptionelle Aktivierung einer Vielzahl von für glatte Muskelzellen spezifischen Genen. Eines dieser von Myocardin transkriptionell aktivierten Gene ist der für glatte Muskelzellen spezifische Kaliumkanal KcnmbI. Die Forscher konnten zeigen, dass KcnmbI nicht nur durch miR-1-vermittelte Regulation von Myocardin, sondern zusätzlich auch direkt durch miR-133 reguliert wird (Abb. 3).

Andererseits aktiviert Myocardin auch die Transkription seines Repressors miR-1/133, was zu einem komplexen Rückkopplungsmechanismus führt. Die durch die miRNA miR-1 vermittelte Repression balanciert die Expression des Transkriptionsfaktors Myocardin und kontrolliert somit die Expression von Genen, welche üblicherweise für glatte Muskelzellen spezifisch sind, deren Expression aber im Verlauf der embryonalen Entwicklung von Kardiomyozyten zunehmend begrenzt werden muss. Aufgrund der Clusterung und gemeinsamen transkriptionellen Kontrolle von miR-1 und miR-133 gelangt miR-133 ebenfalls unter die Kontrolle dieses Regelkreises und kontrolliert koordiniert die Expression weiterer Proteine wie KcnmbI, welche von Myocardin aktiviert werden können und deren Expression spezifisch in Kardiomyozyten begrenzt werden muss.
Zusammengefasst ermöglichen miRNAs, welche hier durch Clusterung zu funktionellen Einheiten zusammengefasst sind, eine weitere Ebene der Regulation, welche die Komplexität der Regulationsereignisse in eukaryotischen Zellen auf posttranskriptioneller Ebene massiv erhöht. Die Arbeitsgruppe um Böttger identifizierte miR-1/133 als einen essenziellen Bestandteil für einen lange bekannten, für die Entwicklung des Herzens bedeutsamen Prozess. Im Fokus der weiteren Untersuchungen stehen die molekularen Mechanismen der Funktion von miR-1/133 im adulten Herzen, sowohl im Zusammenhang mit der Steuerung physiologischer Prozesse, als auch bei pathophysiologischen Veränderungen.


